新薬を期待する患者にとっての治験参加と治験制度とは
厚生労働省は、今年7月に改正した薬事法にともない、医師指導型の新薬治験(承認前の医薬品臨床試験)に力を入れ始めた。
看護士などを中心として推進されてきた治験コーデネーターを今後3年間で5000人に増やすなどとともに、大学病院や各医療センターなどで構成する大規模治験ネットワークを作り、ニーズの高い未承認薬の選定や治験の期間を短縮するよう国内の体制を整備することになった。
このことは97年に起きたソリブジン薬害事件における反省からの改革であるが、被験者は常に患者でもあることからその運用には注意が喚起される。医療の向 上に欠かせない質の高い治験をいかに進めるべきかについて、治験問題に詳しい聖マリアンナ医科大学病院治験管理室室長の小林真一教授と、東京都立北療養育 医療センターの別府宏圀院長に意見をうかがいながら考えてみた。

小林真一 (こばやし・しんいち)
1979年昭和大学大学院医学研究科(薬理学博士課程)修了。英ロンドン大学Royal Postgraduate Mededical School臨 床薬理学教室留学などを経て、96年より聖マリアンナ医科大学病院治験管理室室長。第22回日本薬理学会年会会長、日本薬理学会医評議員他多くの役職を務める。

別府宏國 (べっぷ・ひろくに)
1938年ソウル生まれ。2000年より東京都立北療養育医療センター院長。「医薬品・治療研究会」代表。『The Informed Prescriber(正しい治療と薬の情報)』誌編集長。薬害オンブズパーソン委員、医薬ビジランスセンター副代表。
海外に遅れをとった日本の治験
1つの新しい薬が開発され、世の中に登場するまでには、膨大な年月と費用を必要とする。
日本では、10年以上もの長い期間と100億円ものお金がかかるといわれる。
薬の開発のプロセスとそれぞれに要する期間は、およそ表1のようなものだ。薬は当然のことながら、人間に役立つことを目的に開発されている。したがって、 薬の候補となった化合物の効き目や安全性を正確に知るためには、最終的には人間の身体で試す治験(臨床試験)が必要になる。治験は、病院などの医療施設に おいて、表2のような三段階にわたって実施される。
日本の治験は、欧米のそれと比べると2~3倍も時間がかかるといわれる。そして、このところ欧米の治験件数はどんどん増えて新薬開発のスピードが加速して いるのに、日本のそれは激減している。理由は、日本では人員不足などのため医療施設が治験に対応できる体制をなかなか作れないことや、対象患者を一度に集 めにくいことなどが障害になっているためといわれる。
日本の薬は別名「ゾロ新」といわれる。「ゾロゾロと似たり寄ったりの新薬ばかりが次々出てくる」ことを指す。日本の薬価基準制度では、新薬には特別高い薬 価がつけられ、時間が経つにしたがい値段が徐々に下げられる。だから製薬会社は、化学構造式をほんの一部だけ変えただけで、効果はあまり変わらない「ゾロ 新」開発に力を入れてきた。このことも、日本が治験や画期的な新薬の開発で、欧米に遅れをとることになった理由の一つとされている。

小林:意義は重要なのにマイナスイメージが強調されすぎ

「日本で治験が進まないのは、文化的な問題も含めていろいろな要素が考えられます。
1つはマスコミを通じて得る治験に関する情報が偏りすぎて、治験に対するマイナスイメージが強いことです。たとえば治験薬で問題が起きた時、製薬会社が賄 賂を贈った時、医者がデータを捏造した時など、国民のほとんどは事件報道を通じてしか治験という言葉を耳にしません。その結果、患者さんから『どうして私 が製薬会社の、また先生の実験材料にされるのですか?』というふうに拒絶されるケースが少なくないわけです。
また、日本では国民の医療を支えてきた皆保険制度が、治験を進める上では障害になっている面もあったようです。日本の患者さんは、『治験はリスクばかり』 というふうに誤解していることが少なくありません。保険医療が基本である日本では、『医療はほとんど無料』という感覚ですが、アメリカなどは国民の3割し か保険に加入していません。アメリカや中国では、『治験に参加して初めて医療を受けられる』というところもあり、これは(治験を受ける)非常に大きなモチ ベーションとなっています。

治験の参加に同意を得るためには、患者さん本人が治験の意義とか危険性について理解しなければなりません。日本では、患者さんはマイナスイメージからス タートするわけですから、長い時間をかけてゆっくり説明していく必要があります。ところが、現在の医療制度のなかでは、大学病院などの医療機関でも、一人 の患者さんに対する説明に一時間も二時間も割くことはできません。もう一つは、いままでの医師と患者さんの関係は、パターナリズム(家父長主義)のもとに あって、患者さんは医師に質問しにくいところがありました。こうした状況から、患者さんは一応説明は受けたけれど理解できないことになり、その結果『治験 はイヤ』ということになっていたのです」
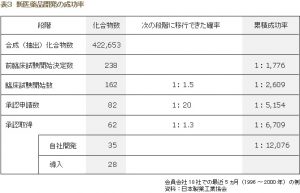

別府:お粗末な新薬承認・説明不足・不透明な治験委託費
「日本で使われている薬の中で、海外では通用しないものが少なくありません。日本では効果がよくわからない薬、必要のな い薬が?新薬?と称して承認されることが多いからです。ある時期、海外から日本の医薬品に対する批判が出てきました。それらがとても当を得たものであった ために、国内でも薬に対して批判が起こったのです。
一方、治験は患者さんの協力を得て行うものなのに、その説明が十分なされていません。医師は治験への参加を要請する患者さんに、『現在の薬はこういう状況 である』『いちばん標準的な薬はどんなものであり、それにはこういう問題がある』『今回試す新薬はこういう理由があって生まれた』『こういう効果が期待で きるけれど、こういうリスクも考えられる』といった、具体的な情報をきちんと説明しなければならないはずです。
また、治験を行う医療機関には製薬会社から『治験委託費』が支払われますが、その収入自体が医療機関にとっては『目的』になっているという問題がありま す。大学の医局では、このお金を様々な必要経費に当てますが、それがだんだん高じて、治験は『必要悪』と見なされるようになったりしました。『本当に必要 ないい新薬を開発しよう』という、本来の目的が忘れられる面があったわけです。
かつては治験の取りまとめ役をする医師が存在し、非常に大きな役割を持っていました。『治験総括医師』と呼ばれるこれらの医師を中心に、不都合なデータが 隠されたり、修正されるなど、ずさんな治験が横行しました。そして薬の効果が、まるでどんぶり勘定のように、『全般改善度』といったあいまいな表現で示さ れたのです。製薬会社との癒着から、様々なスキャンダルが報道されたこともあいまって、治験に対する国民の信頼が損なわれ、治験に参加する患者さんが減少 しました」
治験の質を守るルールが作られた
薬の臨床試験の実施にあたっては、GCP(Good Clinical Practice=医薬品の臨床試験の実施の基準)というルールを守らなければならないことになっている。治験を科学的かつ倫理的に行うための基本ルールだ。
日本では1982年に発覚したある製薬会社による治験データ捏造事件をきっかけに、1990年に初のGCPが施行され、治験審査委員会の設置や、治験参加 への同意取得のための説明義務などが設置された。ところが、「治験総括医師」と呼ばれる治験の取りまとめ役をする医師の役割が大きすぎて内容はきわめて不 十分なもので、ずさんな治験が横行し、行政監査でもGCPの不適切な実施状況が指摘された。


治験検討委員会に参加する治験コーディネーターたち
そのためGCPは97年に改定されており、これ以前のGCPを「旧GCP」、新しいものを「新GCP」と呼んでいる。それまで被験者に治験の目的や 方法・予想される効果や副作用などについてインフォームド・コンセントをして口頭で了解を得ればよいとされていたのに対し、新GCPでは文書で確認をする ことが求められるようになった。このほか倫理的な規定が強化されて、製薬会社の責任がより明確化され、計画の立案、モニタリング、監査、諸記録の管理など の方法がきちんと定められ、以前より治験が安全に、信頼性をもって進められる環境が整えられた。
ところが、薬効の評価にあたって、医師の主観に頼る「全般改善度」という指標が、いまだに重視されたり、多施設共同研究では参加施設が多く、一施設あたりの対象患者が少なすぎる結果、成績のばらつきや不一致がデータの信頼性を損なうという問題が今も続いている。

医療機関にはがんの治験を求めてさまざまな所から薬剤が送られてくる
小林:規則のシンプル化で世界の基調にマッチ
「治 験といえども、参加する患者さんの希望は自分の病気が治ることであり、研究者にとってはその人に何か あったら困るのだからきちんとしなければなりません。治験の倫理的な世界の基調はヘルシンキ宣言であり、その規則をシンプルにすると、治験計画書を作る、 第三者的委員会により治験実施の承認を得る、披験者の同意を得るという三つで、絶対必要です」
別府:ゾロ新薬を生み出す構造は健在
「GCPの不適切な実施状況は、行政監査でも指摘されていました。新しい制度が導入されて以後に登場した薬の中にも、疑問のある薬が少なくありません。ゾ ロ新薬がいまだに承認され続けているのは、『開発に費用がかかる』との理由から、薬価を必要以上に高くつりあげる製薬会社の姿勢に加えて、安易に新薬に飛 びつく日本の医師たちの悪習によるといえます」
治験のグローバル(国際)化がはかられている
薬は人類共通の貴重な財産だ。優れた薬は、それがどこの国で開発されたものであろうと、医師や患者ができるだけ早く利用できることが理想といえる。
ところが、現実には日本で承認された薬であっても海外ではすぐに販売できないし、反対に海外で承認されたものも、日本ですぐに販売することはできなかった。
それぞれの国には、どんな薬が有効で安全かを定めた独自の基準があり、同じ新薬であっても国が違えば認可を得るために、一から臨床試験をやり直し、必要なデータを揃えなければならなかったのだ。
 治験には充分な説明が必要だ
治験には充分な説明が必要だ
そこで、1980年代後半から、医薬品市場の国際化の動きに合わせて、薬の開発の主流である日・米・欧の三地域で医薬品の承認制度を統一することが検討さ れるようになった。これをもとに、医薬品行政担当および製薬業界の代表者が定期的な会議(日米EU医薬品規制調和会議=ICH Interenational Conference on Harmonization)を開き、その論議の結果をもとにICH-GCPが作成された。これにより臨床試験に関する国際標準のガイドラインが定めら れ、日本でも新GCPとして実施されることになったのである。
この結果、厚生省(現厚生労働省)は98年、製薬会社が国内で「ブリッジング試験」と呼ばれる小規模な治験をすれば、海外のデータをそのまま活用できるよ うにしている。ブリッジングとは「橋渡し」という意味で、外国人と日本人の間で基本的なデータが同じならば、その臨床データを当てはめることができるよう にしようというもの。患者ができるだけ早く新薬の恩恵を受けられるよう、薬のグローバル化がはかられたわけだ。
小林:人種による薬物代謝の違いが解明
「たとえば肝臓の薬物代謝が、人種によってかなり異なることがわかってきました。白人はお酒が強く、日本人はお酒が弱いといわれますが、アルコールも一つ の薬であり、代謝能力の違いを示すものです。こうしたことからブリッジング試験では、たとえばアメリカで承認された薬が20ミリグラムが投与量とされてい る場合、日本人ではどのくらいで効果や副作用が出るかを再検討して、『日本人でも20ミリグラムが適量』というふうに導き出す仕事を行います」
別府:護送船団方式は今も変わらず
「フランスでは、各地域ごとに被験者保護法というものが定められ、治験 に参加する患者さんの安全と人権を法律で保護するようになっています。そして、治験する薬の科学的妥当性、倫理的妥当性を両方からきちんと検討する委員会 がおかれています。日本でこうした機関を作ることを制度化しないのは、基本的にはメーカーを保護して産業育成をはかろうという護送船団方式が今も変わって いないということになります。これでは治験のグローバル化はまだ遠いといえるでしょう」
治験の質向上のための制度もスタート
新GCPの完全実施にともない、「治験が近代的になった」ということを示すような制度も設けられるようになってきた。そのひとつとして治験コーディネーター(CRC=クリニカル・リサーチ・コーディネーター)と呼ばれる専門スタッフが必要とされるようになった。これらの人たちは、看護師や薬剤師などの経験を生かしながら、治験を円滑に進め、被験者のケアや様々な業務を補助する役割を持つ。厚生労働省は3年を目途に治験コーディネーターの5000人体制を目指しているが、患者と治験の橋渡し役としての専門スタッフとしてはまだまだ少ない。
また、新GCPでは、治験審査委員会の役割もいっそう重視され、被験者の立場に配慮した審議が求められるようになった。ただし、それでもいくつかの問題が指摘されている。
たとえば治験審査委員会には、その病院とは利害関係のまったくない第三者がメンバーとして入っていなければならないが、学識経験が豊かで、適切な判断のできる人材を見つけることは容易ではない。その結果、治験がきちんと行われているかどうかを医学的倫理的に審査する資質を持たないような人が委員会の構成員になる可能性もある。審査委員会で信頼できる判断がなされる病院ばかりとは必ずしも限らないわけだ。
小林:幅広く質の高い治験ができる体制が整備
「患者さんに時間をかけて十分説明できる人、患者さんが疑問点を話しやすい人として治験に導入されるようになったのが治験コーディネーターです。治験に参加する患者さんには厳しい選択基準が設けられていますが、これをチェックすることも治験コーディネーターの仕事です。治験は研究ですから、限られた期間の中で、細かい観察項目をチェックしていかなければなりません。さらに患者さんの通院する日程の調整をしたり、医師の診察に付き合って体調の報告をしたり、アンケートをとるなど、幅広いサポートを行います。こうした治験コーディネーターの仕事により、治験の質が高くなり、欧米の治験に見劣りしないデータを出していけるようになると思われます」
別府:コーディネーター自体の質の向上が課題
「確かに、新しい職業として意気に燃えて、一生懸命に仕事をしている治験コーディネーターもいます。一方、やればやるほど矛盾を生じるという笑うに笑えない話もあります。高脂血症治療薬の治験のアシスタントとなったある治験コーディネーターは、患者さんをつなぎとめるために、なんと『食事指導をやった』というのです。コレステロールを下げるための薬を治験しているのに、特定の患者さんに対してコレステロールを下げる食事指導をしたら、薬の客観的なデータは得られなくなってしまいます。つまり、この治験コーディネーターは治験の意味を何ら理解していないわけです。こうしたコーディネーターは、けっして患者の権利を守ることにはならないと思います」
治験空洞化を解消するために求められる国民的理解

今までに使われてきた各種の抗がん剤
新GCPの施行にともない、治験を担う医療スタッフの業務量が著しく増大したために、国内の治験が進まなくなることになった。製薬会社としても日本では治 験にあまりに時間がかかってしまうために、治験を実施する環境がより整っている欧米に開発拠点を移したり、治験そのものを外国で実施しようという方向に動 きつつある。これは「治験の空洞化」と呼ばれている。
空洞化で国内の治験が進まなければ、日本の製薬会社が新しい薬を開発しても、日本の被験者がそれを実際に使うことができるようになるまで、時間が長くかか ることになる。また、外国の治験データを使わせてもらうというばかりでは、治験に伴う薬の副作用などのリスクを、もっぱら外国の被験者に負わせてしまうこ とにもなりかねない。その結果、「日本はリスクを他の国に押し付ける」といった外国の医師たちの非難(治験ただ乗り論)も聞かれるようになった。これでは 国内の製薬産業の研究開発能力が衰退するともいわれている。
小林:このままでは世界に通用しない国になる
「外国人は医学の進んでいる日本で治験に参加する人が少ないことを『理解できない』といいますが、日本人にはわかるのです。つまり、日本人は『何も私たちが参加しなくても、お金ですむことなら外国から買えばいいじゃないか』というふうに考えるわけです。日本では社会のために貢献をして、その結果たとえ自分は直接恩恵は得られなくても、子供たちや他の多くの患者に利益がいく、といった考え方が乏しく、それがますます失われていく傾向にあります。このままいったら、日本はおかしな社会、世界に通用しない国になってしまいます。製薬会社も医師も改めるべきは改めなければなりませんが、国民も正しい情報を多く集め、治験に対する考え方を改めなければならないのではないでしょうか」
別府:臨床試験の情報公開はむしろ後退している
「薬を創ることはもちろん慈善事業ではなく、製薬会社はいい薬で勝負して利益をあげなければいけません。その薬が真に優れているということを万人に納得させるためには、臨床データの公表が不可欠です。ところが、最近は、治験の情報の開示という点ではむしろ後退しており、私はこれが非常に気になっています。製薬会社がマスメディアに広告を出して、治験の参加者の応募をするようになりました。それがいい薬なら患者さんにチャンスを与えることになりますが、その保証がありません。その意味では、広告の規制緩和も疑問があります。医学の父と呼ばれるヒポクラテスが尊敬を勝ち得たのは、彼が失敗を隠さず公表したからだといわれます。医療の原点は透明性を重んじ、秘密を排除することです」
テーラー・メイド医療の時代がやってくる

 電子顕微鏡で見た染色体
電子顕微鏡で見た染色体
ヒトの全遺伝子(ゲノム)は30億の塩基で構成されており、その配列が2000年6月にほぼ解読された。この遺伝子の塩基配列が、人によって違うことか ら、体質などの差が生じることが知られている。ここから特定の病気にかかりやすいとか、薬に対するアレルギーなどがわかるわけだ。
私たちの体には、約10万種類もの遺伝子があるが、そのうち役割がわかっているものはわずか五%程度にすぎない。こうした、遺伝子情報の解明によって、がんや痴呆症など、遺伝子に異常があって起こる難病に対する新しい薬の開発も期待されている。
たとえば2001年には、乳がんに有効なハーセプチンという新薬が発売された。従来の抗がん剤とはまったく異なり、遺伝子診断によって有効な患者とそうでない患者の判別ができる。薬による副作用がなく、安全に使用できるようになったとされる。

 大腸がん抑制遺伝子が発見された5番の染色体地図
大腸がん抑制遺伝子が発見された5番の染色体地図
また、胃がんの原因になるといわれるピロリ菌の駆除薬の効果は、薬の代謝酵素を調節する2C19という遺伝子の活性と関係することがわかってきた。とく日 本人には2C19の欠損率が高いため、ピロリ菌の駆除にはこの遺伝子を調べて投与法を決めることが必要だと指摘されるようになっている。
ゲノム時代を迎えるとともに、遺伝子自体が一種の薬と考えられるようになり、薬の概念が大きく広がってきた。遺伝子と病気との関係は、まだ研究が始まったばかりだが、近い将来、その人その人の遺伝的特徴に応じて、薬の種類や用法や用量をきめ細かく決定する「テーラー・メイド医療」の時代がやって来るといわれる。二一世紀の新薬開発の鍵は、このテーラー・メイド医療に結びつく、「ゲノム創薬」が握っている。
しかし、ゲノム創薬にはこれまでの薬よりはるかに膨大な研究開発費が必要だ。そのため、世界の大手製薬会社の間では、相互に合併して大型化する動きが加速している。そして、日本の製薬業界も、この急速な国際化の波にさらされている。


電気泳導で遺伝子を選別する
本当に必要とされている医薬品は、広く人類に貢献し、グローバルに通用するものであるはずだ。テーラー・メイド医療の時代がやってくるとはいえ、1人の患 者を「個別化」するのは、臨床医の仕事である。個別化の前には確固としたスタンダード(標準)の確立が欠かせない。日本の治験の現場では、そうしたスタン ダードなデータを出すための研究がようやく緒についたといえそうだ。